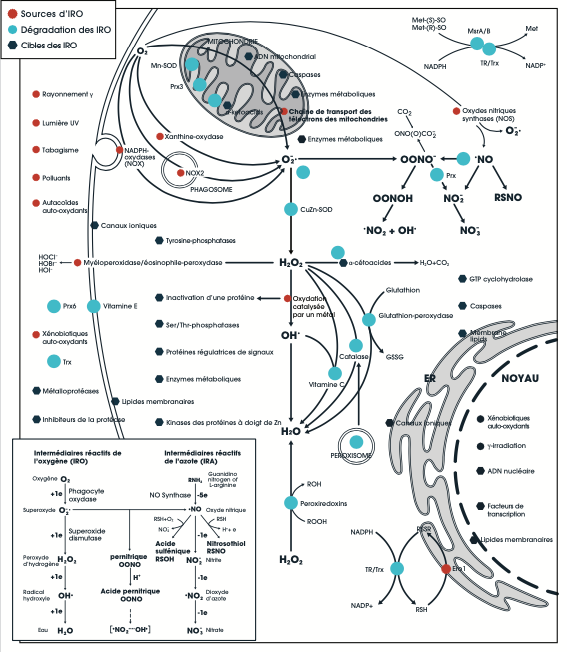
Les intermédiaires réactifs de l’oxygène (IRO) et les molécules apparentées; leurs réactions, leur spécificité, leurs sources (rouge), leurs cibles (bleu foncé) et les voies cataboliques (bleu clair; défenses antioxydantes). Pour une discussion détaillée, voir Nathan C, et Ding A. Cell. 2010;140(6):951-951.
IRO, ERO et IRA : Les IRO sont des produits de réduction de l’O 2 préalables à la formation d’H2O (en médaillon); ils comprennent le radical superoxyde (O2−, O2•−), le peroxyde d’hydrogène (H2O2) et le radical hydroxyle (•OH). Les espèces réactives de l’oxygène (ERO) comprennent les IRO, l’ozone (O2) et l’oxygène singulet (1O2). Les IRO et les ERO peuvent aussi inclure l’acide hypochloreux (HOCl) et d’autres acides résultant de l’oxydation d’haloïde. Les intermédiaires réactifs de l’azote (IRA) comprennent le radical de monoxyde d’azote (NO, •NO), le radical de dioxyde d’azote (•NO2), le nitrite (NO2−) et le peroxynitrite (ONOO−).
Réactions : Covalentes, mais souvent réversibles, comprenant l’H2O2 avec des sulfhydryles, p. ex., cystéine (RSH) et produisant des disulfures (RSSR’); et le NO avec des sulfhydryles produisant des S-nitrosothiols (RSNO). Les réactions avec des macromolécules font intervenir quelques atomes précis de ce type, ce qu’on appelle « spécificité atomique ». Par exemple, les IRO réagissent avec le sulfure, mais généralement uniquement celui de la méthionine ou de la cystéine comme celles des sites actifs des tyrosines phosphatases. À des taux élevés, les IRO sont toxiques, comme toute signalisation dont les paramètres de temps, de lieu, de concentration ou de durée sont anormaux. Les IRO coordonnent les voies de signalisation par leur dépendance à l’égard de l’oxygénation, du transport des électrons, de l’activité enzymatique, de l’état d’oxydoréduction et des concentrations d’alpha-cétoacides, de NADPH et de NADH. Les réactions irréversibles comprennent les hydroxylations, les carbonylations, les halogénations amines, les nitrations et la destruction des amas de fer-sulfure.
Sources : Entre 1 % et 2 % des électrons sortent de la chaîne de transport des électrons (CTE) mitochondriale sous forme d’O2− ; l’hypoxie augmente les concentrations d’IRO par le dérèglement de la CTE. Le NO, l’OONO− et la concentration élevée de Ca2+ intracellulaire favorisent aussi la production d’IRO. Une source importante d’IRO comprend les NADPH-oxydases (NOX) activées par les cytokines. Les oxydes nitriques synthases (NOS) produisent de l’O2− lorsqu’elles ne sont pas couplées par hypoxie ou oxydation. Les oxydations catalysées par le fer comprennent les réactions de Haber-Weiss et de Fenton (production de •OH catalysée par les formes ferriques et ferreuses). La Xanthine oxydase est une source d’IRO pendant l’ischémie et la reperfusion qui s’ensuit. Les rayonnements γ produisent des radicaux •OH. La lumière UV produit 1O2 et entraîne la production de NOS2. Les polluants atmosphériques contiennent des ERO et des radicaux organiques.
Cibles : Les tyrosines- et sérines-/thréonines-phosphatases possèdent des résidus de cystéine à site actif pouvant faire l’objet d’une inactivation oxydative réversible affectant les voies des kinases (p. ex., MAPK). Les IRO oxydent les cystéines qui coordonnent les ions Zn2+ dans les protéines à doigt de Zn2+ , ce qui entraîne l’activation de la protéine kinase C. Les métalloprotéases subissent l’oxydation des résidus cystéines, ce qui maintient l’état inactif. Les caspases sont inhibées par la cystéine, ce qui bloque l’apoptose. L’oxydation de la cystéine affecte la régulation des signaux par les protéines à choc thermique. Les facteurs transcriptionnels subissent une activation oxydative (Nrf2, NF-κB). Les enzymes métaboliques sont inhibées par les IRO. Une conséquence majeure de l’H2O2 est la décarboxylation oxydative des alpha-cétoacides (pyruvate, alpha-cétoglutarate et oxaloacétate du cycle de l’acide citrique). Les protéines sont inactivées à la suite de l’oxydation catalysée par un métal et la carbonylation de l’arginine, de la lysine, de la proline et de la thréonine. Les inhibiteurs de la protéase qui freinent les lésions tissulaires pendant l’inflammation sont inactivés par l’oxydation. Les IRO activent les canaux ioniques, ils provoquent une mutagenèse ciblant l’ADN nucléaire et l’ADN mitochondrial, et leurs effets sur les lipides ont de vastes répercussions.
Dégradation : La CuZn-superoxyde dismutase (SOD) dans le cytosol et le Mn-SOD dans les mitochondries convertissent l’O2− en H2O2. La catalase contenue dans les peroxysomes agit sur l’H2O2. Le cycle du glutathion (GSH) est alimenté par la NADPH, ce qui réduit les ponts disulfures (S-S), fournit un électron (e-) aux peroxirédoxines (Prx) ou à l’ascorbate, et inverse les liaisons protéine S-nitroso. Le cycle de la thiorédoxine (Trx) est lui aussi alimenté par la NADPH; il réduit les ponts S-S et fournit un e- aux Prx, ainsi qu’aux méthionine-sulfoxide (MetSO)-réductases et à la ribonucléotide-réductase. La Prx 1-6 réduit l’H2O2, les peroxydes organiques et l’ONOO−. Les MetSO-réductases détoxifient l’H2O2, comme le font les alpha-cétoacides. L’ascorbate réduit l’H2O2 et piège les radicaux •OH alors que les tocophérols (vitamine E) réagissent avec les radicaux lipidiques produits par les ERO.